Réécouter le webinaire
Do it by Design: How Usability Brings Value to Risk Controls
- Enregistrement: 50 min
- Langue: Anglais seulement
Guidée par la norme IEC 62366-1, l’ingénierie d’utilisabilité se focalise principalement sur les risques d’erreurs liés à l’utilisation afin de concevoir des produits plus sécuritaires et centrés sur les utilisateurs.
Asra Saleh est experte en gestion des risques au sein de l’équipe d’assurance qualité de CLEIO. Il y a quelques mois, elle a animé un webinaire pour Greenlight Guru pour parler du rôle et de l’impact de l’utilisabilité dans le contrôle des risques.
L’ingénierie d’utilisabilité pour améliorer la sécurité d’utilisation des dispositifs médicaux
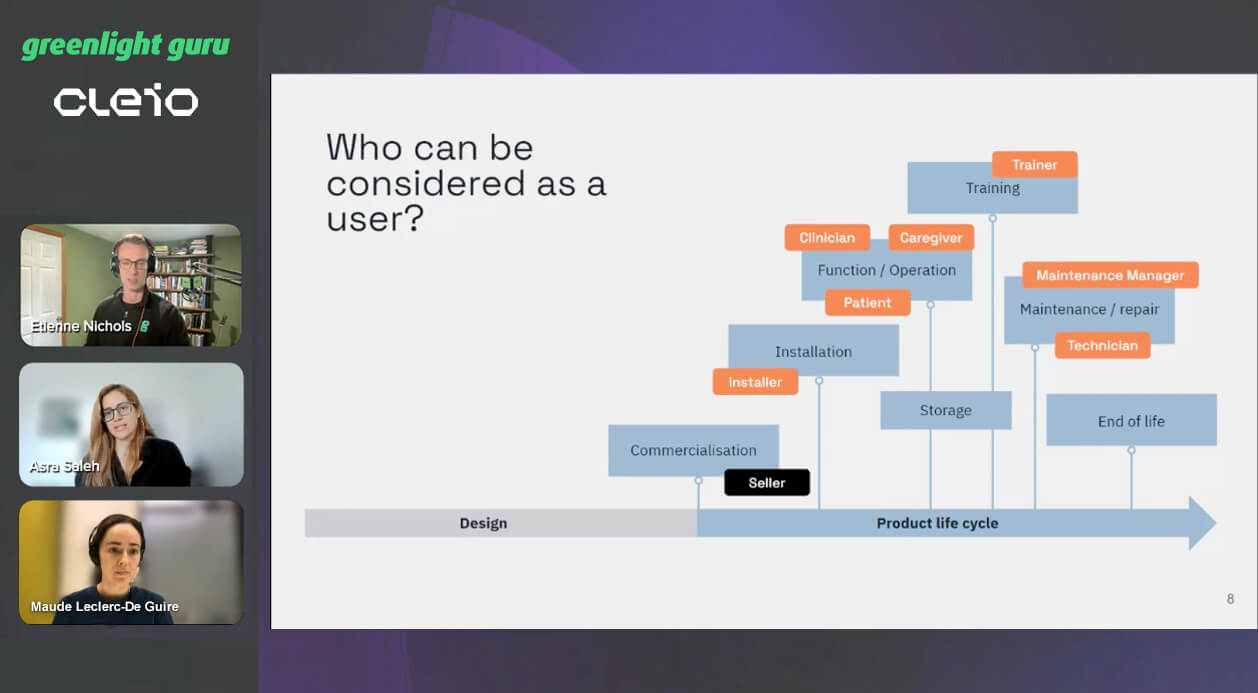
Les risques liés à l’utilisation du dispositif médical
L’objectif de l’ingénierie d’utilisabilité est d’identifier les risques potentiels liés à l’utilisation afin de les mitiger pour les rendre acceptables: si le risque zéro n’existe pas, autant le rendre le moins dangereux possible.
Le processus de design centré utilisateur
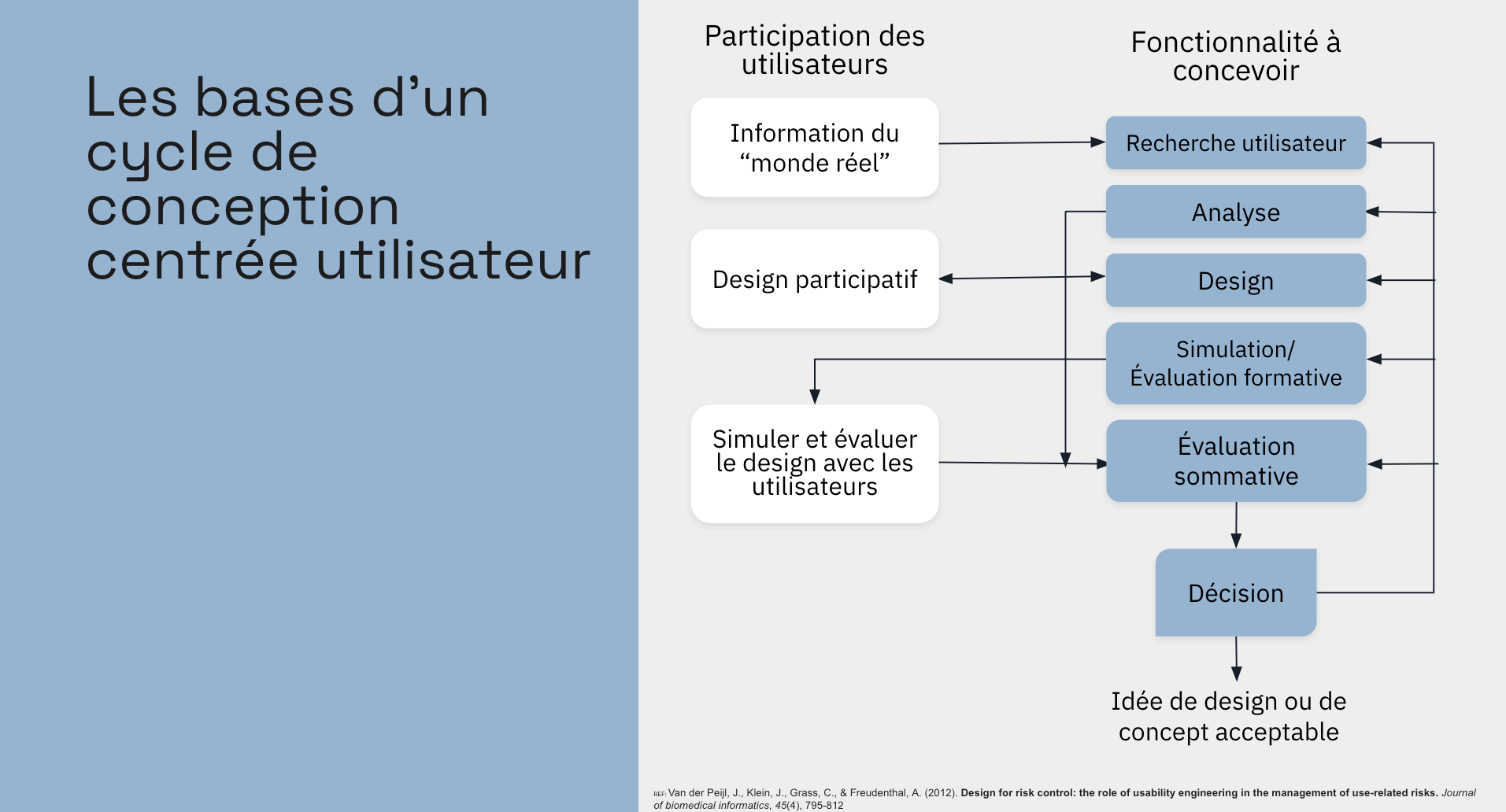
Comment concevoir pour contrôler les risques?
Établir la liste des risques liés à l’utilisation
- Les défaillances techniques
- Les problèmes de fonctionnement du dispositif
- Les compétences de l’utilisateur
- L’environnement d’utilisation
- Les scénarios impliquant le patient
- La disponibilité du personnel formé
La norme IEC 62366-1 suggère également de passer en revue les bases de données publiques comme le TPLC (Total Product Life Cycle) pour récolter des informations sur les éventuels rappels qui ont eu lieu dans le cas où des événements indésirables seraient survenus avec des produits similaires.
Appliquer une stratégie de contrôle des risques
- Modifier le design du dispositif médical
- Intégrer des mesures de protection dans le dispositif lui-même
- Donner des informations relatives à la sécurité à l’utilisateur (avertissements écrits, contre-indications, formation)
Intégrer les activités d’utilisabilité et de gestion des risques conjointement et en continu
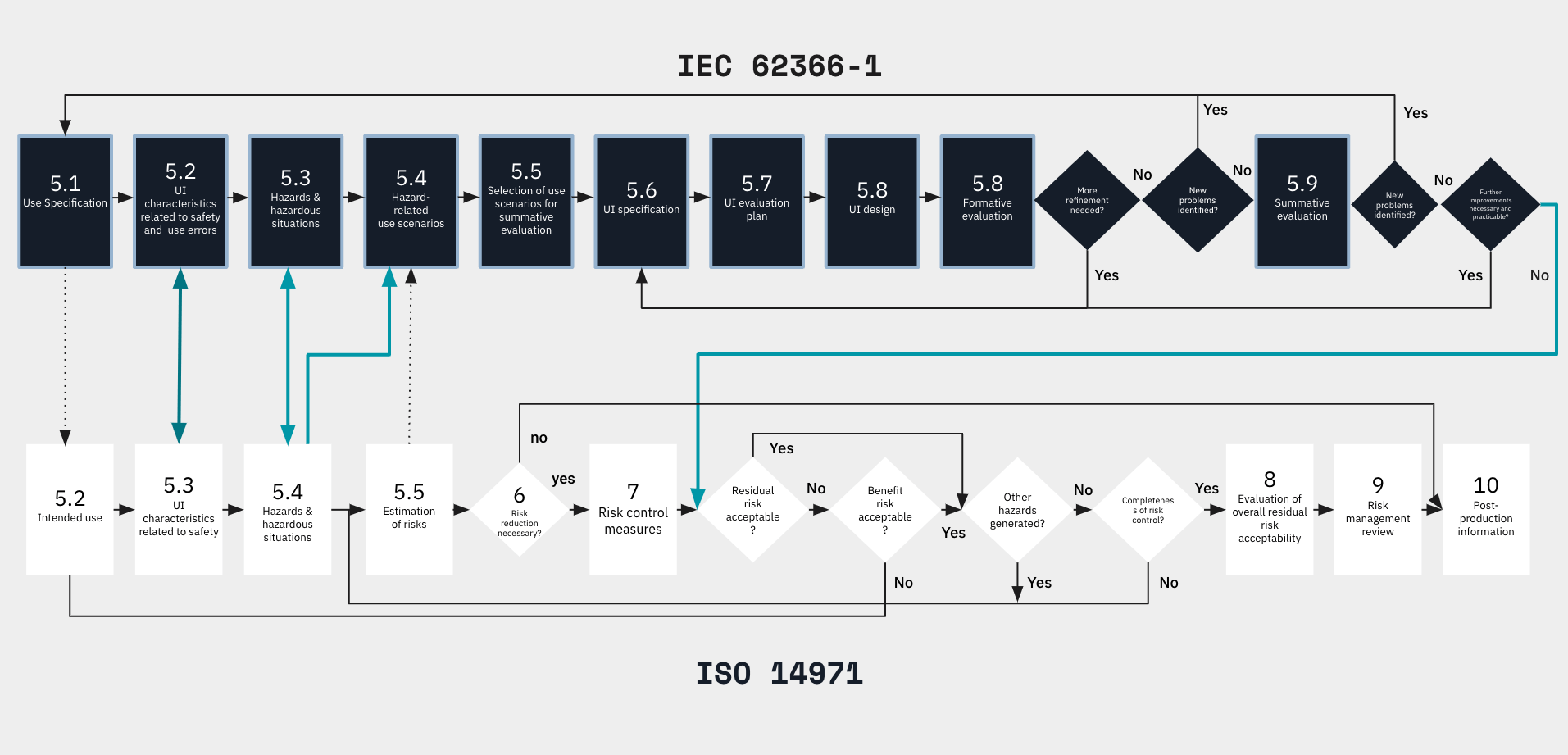
- Au cours de la phase d’analyse (5.2 → 5.4) où les caractéristiques liées à la sécurité, aux dangers prévisibles et aux situations dangereuses sont identifiées.
- Après la phase d’évaluation où il est essentiel de vérifier si des dangers supplémentaires sont apparus et si tous les dangers ont été pris en compte.
Appliquer les méthodes UX
- Entrevues avec des utilisateurs
- Enquêtes contextuelles
- Évaluations heuristiques (ou audits ergonomiques)
- Inspections cognitives
- Tests d’utilisabilité
- Comprendre le contexte et l’environnement d’utilisation
- Définir les profils des utilisateurs et comprendre leurs besoins
- Organiser des sessions de brainstorming avec d’autres membres de l’équipe possédant une expertise spécifique
- Évaluer l’utilisabilité du produit afin de prendre des décisions de design éclairées
- Améliorer l’expérience utilisateur
Quand est-ce que c’est suffisant?
D’ailleurs, c’est comme ça que ça se passe chez CLEIO: notre équipe experte en facteurs humains et notre équipe d’assurance qualité collaborent étroitement. Pour les dispositifs médicaux que nous développons, c’est l’assurance que les risques liés à l’interface utilisateur soient mitigés et que les risques résiduels globaux soient acceptables. Tout cela avec un seul objectif en tête: obtenir un produit sécuritaire, à la fois, pour le patient et pour le professionnel de santé.